光學同調斷層掃描術的臨床應用趨勢與挑戰
Clinical Trends and Challenges of Optical Coherence Tomography
光學同調斷層掃描術 (optical coherence tomography, OCT) 目前在眼科已成為標準的檢驗技術,每年影響上千萬病患的治療流程,而 OCT 的發明至今不到 30 年,對生技醫療領域而言,這麼短的時間,就取得如此成就,非常罕見。目前全球已有超過 100 家 OCT 公司,從事 OCT 技術與應用的開發,在應用面,由眼科、心臟科、皮膚科、腸胃科乃至神經外科,均已獲致大量的臨床及前臨床成果;而在技術面,OCT 所需的寬頻光源及探頭亦進展快速,使得 OCT 的成像速度、解析度及探頭所能檢驗的組織種類均大幅提昇。在生物醫療領域,OCT 是一個極佳的成功案例,本文將簡介 OCT 的原理、技術、應用及趨勢與挑戰,希冀對 OCT 有興趣的讀者有所指引,也希望對生醫影像的研發團隊有所啟發。
Optical coherence tomography (OCT) was invented less than 30 years ago, and it has now become a standard of care impacting the treatment of millions of people every year. In biomedical field, it is rare to have such an achievement in such a short period of time. At present, there are more than 100 OCT companies worldwide dedicated to the development of clinical applications as well as technologies. Application wise, there are tremendous clinical and preclinical progresses in ophthalmology, cardiology, dermatology, gastroenterology, neurosurgery, etc. Technology wise, the OCT imaging speed, resolution, and functionality are advancing rapidly due to the breakthroughs in broadband light sources and various optical probes for reaching the deep and/or interior tissues and organs. In the biomedical field, OCT is a successful role model for medical devices. In this article, the basic principles, technologies, applications, as well as the trends and challenges are addressed. Hopefully, it could serve as a guideline for interested readers and inspire the medical image developing teams for making impacts.
一、OCT 的基本原理
OCT 的光學原理,基本上是白光干涉術 (white light interferometry),此處白光是泛指各波段的寬頻光源,但由於特殊的干涉波包 (envelope) 提取方法,使得 OCT 能很便捷的分析待測物體結構上的特性(1, 2)。顧名思義,OCT的成像原理就是利用其同調性 (coherence) 加以成像,對雷射光源而言,由於同調性高,因此,將光束一分為二後,再加以合束,就極易觀測到干涉現象,但對低同調光源 (即寬頻光源) 而言,分光後須走同樣的長度,再加以合束,才可觀測到干涉現象,因此,同調性愈低 (即頻譜愈寬) 對空間的鑑別率愈高,使得不同深度的組織樣本,因結構變化產生的背向散射,可於掃描的干涉訊號中,被個別定位出來,以達到光學切片 (optical sectioning) 的效果。如圖 1 所示,以邁克爾遜干涉儀的架構而言,分光後之二束光分別稱為參考光束及樣本光束,由於 OCT 是以低同調光源為起始光束,由樣本背向散射回來之光束,須與參考光束經過等長的距離,才會形成干涉信號,因此,若是連續改變參考光束的行經長度,便可偵測到在樣本不同深度的背向散射源 (即折射率改變之處,也即是組織內結構或成分改變之處),若再加以橫向掃描,便可得到二維或三維的 OCT 影像。

圖 1. OCT 基本架構。
就技術面而言,OCT 可粗分為時域式 (time domain) 及頻域式 (frequency domain 或fourier domain) 兩大類,兩者各有其優勢,前者以點偵測器接收干涉光,可有最大的信號動態範圍,以二維光偵測器 (如 CMOS sensor) 接收,則可有高速的全域式 OCT (full-field OCT, FF OCT) 成像;後者一般分為頻域式 (spectral domain) 及掃頻式 (swept source) 二種,頻域式藉由頻譜分析儀來得到寬頻的干涉信號,而掃頻式則藉由掃頻雷射來產生寬頻的干涉信號,表 1 摘要了這些技術,在光源臂、參考臂及偵測臂之成像方法差異。圖 1 中,由光偵測器所接收的兩道重合之干涉光的光電流 (ID) 可由式 (1) 表示(3)。

ρ 為光偵測器的光電轉換效率,s(k) 代表其入射光對不同波長λ的光電場振幅的分布;k 為波數,ν 為光電場頻率,rR 為參考端反射面的反射係數;zR 為參考臂的物理長度。rS 為樣本結構面的背向散射係數;zS 為該組織結構對應的樣本臂長度。
表 1. 各式三維 OCT 成像方法。Dω 代表寬頻光源;ω(t) 代表掃頻雷射;τ(t) 代表可調參考臂光程;τo 代表固定參考臂光程;0D, 1D 及 2D 分別代表點偵測器、一維光偵測器及二維光偵測器。

由於一般光偵測器的反應速度遠小於光電場的頻率,因此偵測到之光電流為式 (2) 之時間積分,可簡化成為式 (1),為一般常見的干涉訊號模型。
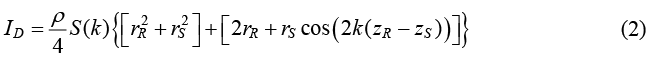
S(k) ≡ |s(k)|2,式 (2) 中的第一個中括號項,表示參考端反射光與所有樣本散射光各自本身的強度項,其為常數項,不會隨掃描時調整的變數 (參考臂長 zR) 變化,在光電流上呈現為一個直流訊號。第二個中括號項,為樣本端與參考端之間光的干涉項,這一項為 OCT 主要分析的訊號。經過適當的操作處理,來解調出此項中樣本結構的資訊 rS 和 zS。假設原始的光源的光譜為高斯函數分布,其功率頻譜 (power spectrum) 以式 (3) 表示。

k0 為光譜中心波數;Dk 為光譜的頻寬。根據 Wiener-Khinchin 定理,一個函數的自相關函數(autocorrelation function)的傅立葉轉換為其功率頻譜。因此,S(k) 的傅立葉轉換會得到原始光源在空間上的自相關函數 γ(z),如式 (1) 所示。

這裡 γ(z) 又被稱為同調函數 (coherence function),其形式便是式 (2) 中的第二中括號項,兩個不同光程的光電場函數乘積。這個干涉訊號在空間上的分布,稱為點擴散分布 (point spread function)。式 (5) 表示了高斯函數光譜的光源相干產生的同調函數,於空間上的訊號同樣也是高斯函數分布。同調函數在兩光電場光程相等 (z = z′) 的時候,呈現最大訊號。而其半高全寬 (full width at half maximum, FWHM),定義為 OCT 的縱向解析度 (la),如式 (1) 所示。
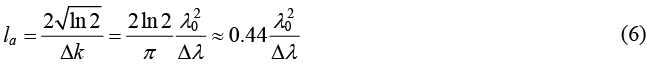
到此可以觀察到,干涉訊號中心出現於當兩光電場光程差為零的位置,且在空間上分佈有一定的範圍 (約其同調長度),而當光源的頻寬越大,同調長度越短,訊號分布也就越窄。式 (1) 的 la 為對平行光入射之縱向解析度,若以物鏡聚焦,除了決定橫向解析度,亦可以其共焦閘 (confocal gate),強化縱向解析度。
就應用面而言,OCT 之二維影像,可粗分為橫截面 (cross section) 及當面 (en face),前者之二維影像包含了入射光所在之面,後者之二維影像則與入射光垂直 (i.e 此二維影像面之法向量與入射光平行)。兩者各有用途,舉例而言,橫截面之影像對觀察皮膚、血管等組織而言,能提供其層狀結構之資訊,而當面之影像,對觀察角膜內皮細胞或亞基底神經 (sub basal nerve) 則較易提供更多之量化資訊。如圖 2 所示,3 種不同皮膚細胞所對應之顯微鏡影像與 OCT 影像,OCT 的三維成像,可輕易區分細胞的真實立體結構,不論球形、扁形,乃至三維核質比 (nucleus-to-cytoplasm ratio),均可實現單細胞分析,雖然大多數 OCT 均可提供三維影像,但此三維影像可由橫截面或當面所拼接而成,在臨床應用而言,拼接方式確有很大差異,包含:在橫截面及當面的解析度及成像速度,均隨所使用的技術而不同,尤其 OCT 主要的應用是在臨床上,因此,病患的心跳、呼吸、眼動均會改變成像的品質,進而影響醫師的診斷決策。
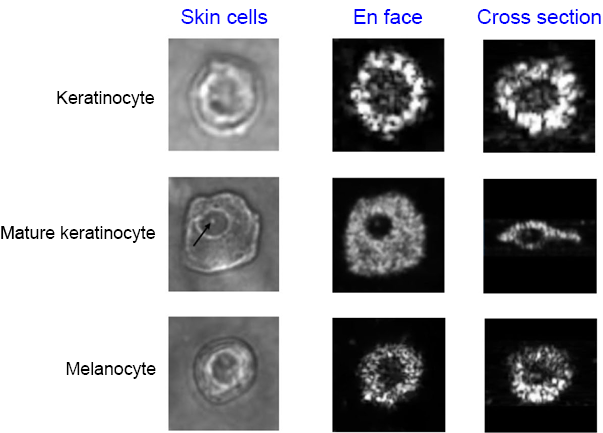
圖 2. 細胞之顯微鏡影像 (左欄) 與 OCT 之三維影像,分別以當面 (En face) 及橫截面 (Cross section) 呈現 (中欄及右欄)(4)。
OCT 經常被與反射式共焦顯微術 (reflectance confocal microscopy, RCM) 相比較,共焦顯微術雖自 1957 年即由 Marvin Minsky 所發明,但實際上應用於生醫檢測做細胞級解析度的成像,約自 1990 年代開始(5),OCT 與 RCM 都可具有細胞級的解析度,且都是偵測生物組織的背向散射信號,但由於光源及成像原理不同,因此其空間解析度與所用物鏡的數值孔徑 (numerical aperture, NA) 的關係,相當不同。如圖 3 所示,對 RCM 而言,其橫向 (x-方向)及縱向 (z-方向,即深度方向) 之解析度與 NA 的關係分別為 NA–1 及 NA–2 的關係,即兩者互相影響,尤其在縱向上,須有高 NA,才能有高解析度,但高 NA,使得雷利範圍 (Rayleigh range) 縮短,因此,RCM 的有效穿透深度較淺 (約 100-200 mm 以內),使得 RCM 較不適用於較深的組織檢測。相對的,OCT 在縱向解析度上,主要由光源的頻寬決定,如式 (6) 所示,因此,可用較小的 NA,達到細胞級解析度,因而能看得更深。由於對 OCT 而言,橫向與縱向解析度能分別設計,因此,對各式波長及頻寬,均可選擇適當的物鏡 NA,使得 OCT 的橫向與縱向的解析度一致,如圖 4 所示,以減少在三維成像時影像失真,達到高品質的成像。

圖 3. RCM 之空間解析度。淺藍區塊及淺灰區塊分別為 OCT 及 RCM 之常見工作區間(6)。
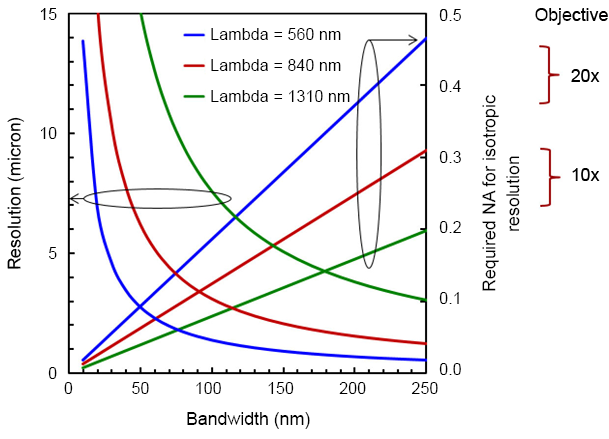
圖 4. 對 OCT 達成各向同性解析度 (isotropic resolution) 所對應之物鏡數值孔鏡。
二、OCT的光源
OCT 目前已廣泛應用於各式臨床及科研的用途,在臨床的應用上,安全性、影像品質、掃描速度及組織穿透深度等,均與 OCT 光源特性密切相關。在安全性議題上,由於 OCT 的信噪比與光源的平均功率成正比,所以,固定功率之光源比起脈衝光源,較可降低高峰值密度對生物組織的光傷害風險;在影像品質上,主要由解析度、畫素串音 (cross talk) 及斑點雜訊 (speckle noise) 等因素所決定,如前所述,高解析度可由寬頻光源、較短的中心波長及短焦透鏡而達成,畫素串音則可由高斯頻譜來降低相近畫素間的串音,斑點雜訊可藉空間濾波減少,但亦會連帶降低 OCT 解析度;在掃描速度上,可藉高亮度光源、高速且低雜訊的一維或二維光偵測器、高速的光束掃頻或掃描機制來達成即時的二維甚至三維成像;在組織的穿透深度上,長波長的散射損耗較低,因此可有較深的穿透,如圖 5 所示,但通常影像的對比度亦因而下降,此外,對頻域式 OCT 而言,較高的頻譜解析度或較窄的掃頻雷射即時線寬,亦可使光偵測靈敏度不會隨穿透深度而快速下滑。綜上所述,針對不同的生物組織或不同的應用,其所最適合的 OCT 光源亦不同,不過一般而言,安全、寬頻及高亮度光源使得臨床上達成高解析及高速成像,最能發揮 OCT 的特色與優勢。
寬頻光源的種類很多,產生的方法亦不困難,但要具有高亮度,就面臨很大的挑戰。高亮度的寬頻光源,基本上為低時間同調性 (temporal coherence),亦可粗分為 2 類,一為低空間同調性 (spatial coherence),一為高空間同調性,前者適用於全域式 (full field) OCT,後者適用於頻域式 OCT。
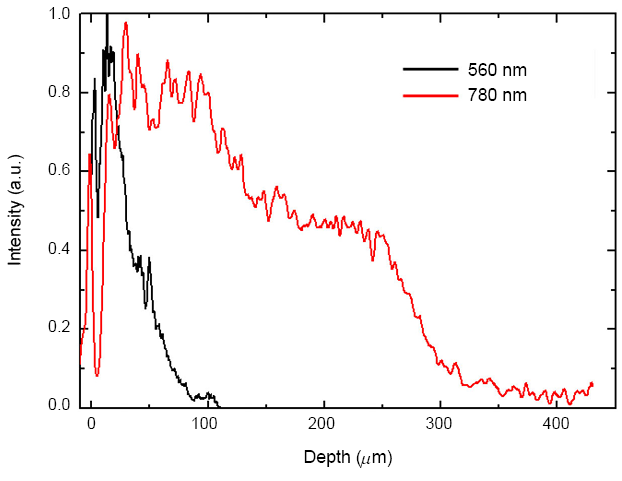
圖 5. 不同波長 OCT 在皮膚之穿透深度。
在相同功率的情形下,光源的亮度越高表示在固定發散角度或是由相同數值孔徑鏡片收集下能得到較高的功率,代表可利用的光越多且因為發散角較小而有較長的工作距離,因此光源的亮度可以當作此光源的特性指標之一,在長距離照明以及光學成像系統中皆需要高亮度的光源。亮度 (brightness) 的定義為單位面積和單位立體角下的功率大小,如式 (7) 所示,

其中,P 為光源接收功率,Ae 為發光面積,W 為光源的發散立體角,若以光纖輸出的光源可利用光纖的數值孔徑換算成立體角,得到式 (8)。

一般而言,固定功率光源有以下幾種,例如:鹵素燈 (halogen lamp) 、發光二極體 (light emitting diode, LED)、超流明二極體 (superluminescent diode, SLD) 以及晶體光纖 (crystalline fiber)(7, 8)。LED 是最普遍且便宜的光源,發光機制為半導體材料製成的二極體,由電流驅動發光,該製程發展成熟,以單色 LED 而言,頻寬不寬,發光面積的長寬為毫米等級,而且發散角為全角度 (4p radiation),因此亮度較低,但是成本低,可以同時使用多個 LED 應用於日常生活中的照明。SLD 的發光原理機制和 LED 類似,主要結構和半導體雷射二極體相同,只是缺少共振腔設計,自發輻射 (spontaneous emission) 光源於增益介質構成的波導中放大,由於是波導結構,其發散角由增益介質和周圍材料的折射率差所決定,但是截面積多為長方形,因此光源發散形狀多為橢圓形或狹長型,但是得益於增益介質截面積的尺寸和光纖相似,因此為了增加其應用多將 SLD 的光耦合至光纖中,形成單模輸出,因此以亮度而言,因為由單模光纖輸出,所以具有發散面積小和發散角小的優點,因此亮度高,但是受限於增益介質為半導體材料,光源的中心波長在 670 nm 至 1600 nm 的範圍之間(9),其頻寬普遍不超過 100 nm,但是可以串聯多個鄰近波長的 SLD 而拓寬頻譜(10)。但是這種設計不僅會增加光源的複雜度,最重要是會導致頻譜形狀不規則且非高斯分佈,在成像上不僅會影響解析度更會有嚴重的像素串音問題,進而降低影像品質。晶體光纖為波導結構,其表面積 (散熱用) 與體積 (產生放大之自發輻射) 之比例,高於塊材 (bulk material) 及半導體之平面波導結構,因此有較佳之散熱,可承受較大之幫浦功率 (pump power) 以產生高亮度寬頻光源。此外光纖結構可以使幫浦光 (pump light source) 和晶體的作用長度不受聚焦光束的瑞利距離 (Rayleigh length) 影響,在十幾微米直徑的光束大小下達到公分等級的作用長度,所以幫浦光可以有效被吸收而激發的光源可以在波導結構中收集並放大,最後經由半徑僅數個微米的極小面積發散,發散角度由光纖本身的數值孔徑限制,而非全角度發散。除此之外,尚有一種寬頻光源,其發光機制是利用高能雷射聚焦在氙氣電漿 (xenon plasma) 上而放光,由於發散角為全角度,需要經由透鏡收集光源,以 Energetiq 公司出產的 EQ-77 機台為例,其波長範圍為 170-2400 nm,單位波長上的平均亮度為 40 mW/(nm·mm2·W),若將該光源的亮度比照 Ce3+:YAG 和 Ti3+:sapphire(8) 晶體光纖 (亮度約 50 W/(mm2·W))的頻寬計算,氙氣電漿亮度約為 10 W/(mm2·W)。
在高空間同調性的寬頻光源發展上,掃頻雷射近年來發展迅速,它是一種新型態的雷射光源,除了已有多家公司的產品,在學術研究上,亦持續有新的架構被發展出來,掃頻雷射雖是脈衝光源,但一般而言,峰值功率不高,相對安全,其於不同時間,出現不同波長的快速掃描,粗略而言可分為二大類,一類為非連續波 (continuous wave, CW) 的脈衝光源,一類為 CW 的脈衝光源。前者藉由電光晶體或多面旋轉鏡結合光柵而達到掃頻輸出,後者則藉由頻域鎖模 (Fourier-domain mode locking) 或脈衝展延 (time stretched) 的鎖模雷射 (mode-locked laser) 而達成 CW 的脈衝輸出,其掃頻速率通常亦比非 CW 的掃頻雷射為高,可達數百萬赫茲的掃頻速率。
三、OCT 的應用
由於 OCT 安全、高速及高解析的特性,使其已廣泛應用於各生醫臨床研究領域,其中眼科為 OCT 重要的發展方向之一,現今已有許多商品化的 OCT 系統廣泛用於臨床眼科的診斷上。OCT 成像術於 1991 年由 D. Huang 等人首次發表時,便是展現 OCT 掃描人類視網膜檢體 (ex vivo) 的成果(1),隨後許多活體 (in vivo) 的 OCT 應用也陸續被發表(3)。因此,OCT的臨床應用,始於對視網膜的橫截面成像,其非侵襲性的特性,使得眼科醫師得以即時看到有別於眼底鏡 (fundus photography) 的視網膜層狀結構,對早期眼部疾病的診斷起了重要效益,之後大量在青光眼 (glaucoma)、糖尿病性視網膜病變 (diabetic retinopathy) 及黃斑部退化 (macular degeneration) 的大量臨床試驗,促成了今日其在眼科每年全球數千萬次的臨床診斷。由於 OCT 在眼科發展歷史已有近 30 年,目前的應用與技術發展,相當多元,在應用面,藉由較長波長 (~1 mm) 掃頻雷射的快速發展,使得視網膜後的脈絡膜 (choroid) 及分佈其內的血管,均可清楚成像,藉由掃頻雷射的高速,血管內血球的動態特性得以被擷取出來,藉由掃頻雷射的窄線寬,亦強化了 OCT 在眼部的高深度成像,目前 OCT 在視網膜及脈絡膜的縱向解析度大約進展到 5 至 10 mm。此外,OCT 在眼部前房亦是發展迅速,藉由 FF-OCT 的次微米解析度,如圖 6 所示,可使得角膜的細胞級三維結構,包含:Vogt 柵欄 (palisade of Vogt, POV)、血管新生及角膜神經,可以被精準的量化,在未來亦有相當大的應用潛力(11)。

圖 6. 對活體兔子角膜之當面影像序列,圖中數字為相對角膜表面之深度,比例尺為 10 mm。由表層細胞 (superficial epithelial layer ~ 0-10 mm)、翼狀層 (wing layer ~ 10-30 mm)、基底層 (basal layer ~ 30-48 mm)。紅色箭頭標示表層及翼狀層邊界,黃色箭頭標示翼狀層及基底層邊界,藍色箭頭標示基底層及前彈力層 (Bowman᾿s membrane) 邊界,綠色箭頭標示神經叢 (nerve plexus)(11)。
一般光源在人體大多數的組織,不像眼睛透明而有高的穿透深度,這時便可藉由內視鏡 (endoscope) 探頭,甚至導管式 (catheter) 光纖探針來引導 OCT 光源做組織之斷層掃描。在心血管的應用上,光纖探針之直徑約 0.9 mm,又必須做三維的血管內成像,技術難度高,但潛在的效益亦極大,心臟疾病在全球開發國家的疾病致死率,均名列前茅。在臺灣,心臟疾病僅次於癌症,為前 2 大首要死因,每年奪走 1 萬 9 千位國人性命,而心臟病的首號殺手就是冠狀動脈 (coronary artery) 狹窄及阻塞。冠狀動脈狹窄是由於在動脈壁的內膜下,脂性物質沈積而逐漸硬化所造成的,這種血管硬化的情形叫做動脈粥樣硬化 (atherosclerosis)。一旦產生粥樣硬化且如果內膜因某種原因發生破裂,血管病變就會迅速發展。動脈內的血液一旦與粥樣硬化斑 (atherosclerotic plaque) 接觸,很快就會形成血塊,早期血塊是由黏性的血小板所組成,隨後血中蛋白脢滲入,形成如同繩索般的纖維,使血小板更易於附著於動脈管壁而形成血栓,它會阻塞供給心臟血液的血管,造成心臟肌肉的壞死。
一般而言,冠狀動脈管道的阻塞沒超過百分之八十以上,流經冠狀動脈內的血流量並無明顯變化,對於一個靜止狀態的患者來說,心肌所需的血流量不受影響,但如果是在運動狀態時,狹窄的冠狀動脈就無法供應心肌因運動而增加的血流需求量,因此在這種心肌血流量供需不足的情況下,患者便會有心肌缺氧的現象產生。目前,已有多家 OCT 公司有血管內 OCT 臨床產品問世,用於粥樣硬化之纖維化表層厚度檢測及區別急性冠狀動脈內血栓成因是由斑塊破裂或是斑塊侵蝕而成。OCT 藉由引導疾變處之血管塑形 (angioplasty),已廣泛應用於經皮冠狀動脈介入性療程 (percutaneous coronary intervention),它可精確辨識血管支架之錯置、剝離及形成血栓等失誤。此外,OCT 亦可輔助監控術後恢復狀況,評估血管內新生內膜 (neointima) 包覆支架之程度及支架內新生之粥樣硬化 (neoatherosclerosis) 之狀況。因此,臨床上 OCT 於血管內病變之偵測已快速的擴散(12),文獻上亦開始有 OCT 於頸動脈、肺動脈、股動脈 (femoral artery) 及膕動脈 (popliteal artery) 之應用。一般血管內 OCT 的解析度,約為 10-20 mm,初步結果顯示 OCT 比起大體檢測可能會有過度診出的現象,例如:以第一代藥物釋放支架 (drug-eluting stent),在大體中只有 11% 之薄層纖維粥瘤 (thin-cap fibroatheroma, TCFA) 檢出,但在 OCT 之臨床檢驗,確有 52% 檢出(13)。藉由更高之解析度 (2-5 mm),有機會區分出 TCFA 之泡沫化巨噬細胞沈積區 (foamy macrophage accumulation) 之邊界,提昇診斷正確率。值得注意的是,近年亦開始有論文探討細胞級解析度對動脈粥樣硬化研究的重要性,以對冠狀動脈疾病做精確的診斷,並了解植入支架的組織病理反應。
OCT 在眼科及心血管的應用,促成了 OCT 技術在掃描速度上的大幅提昇,以滿足臨床上快速成像的需求,近年來隨著 OCT 光源頻寬的突破,細胞級的量測解析度成為可能,這對 OCT 在早期癌症的診斷上,提供了發展的契機。以皮膚癌為例,目前,臨床上 RCM 已發展多年,其縱向解析度遠遜於橫向解析度 (0.25-0.4 mm),所以 RCM 沒有辦法提供清晰的橫截面影像,而只能提供當面影像。而一般醫師對於當面影像並不熟悉,所以 RCM 儀器只限於少數專家使用,不易普及(14)。如圖 7 所示,OCT 可提供細胞級解析度之橫截面影像,有機會對惡性腫瘤做診斷。皮膚癌是最常見的人類癌症。皮膚癌包含基底細胞癌 (basal cell carcinoma)、鱗狀上皮細胞癌 (squamous cell carcinoma) 與黑色素細胞癌 (melanoma)。黑色素細胞癌是最致命的皮膚癌,美國每年約有 70,000 人得到黑色素細胞癌,而約有 9,000 人死於黑色素細胞癌(15)。基底細胞癌與鱗狀上皮細胞癌合稱非黑色素細胞癌皮膚癌 (non-melanoma skin cancer, NMSC)。因為 NMSC 沒有包含在癌症登記之中,所以其實際發生率是用健保申報來估計。最近的報告估計 2012 年美國總共有 331 萬人得到 NMSC,NMSC 腫瘤總數為 543 萬個,也就是平均每個病人有 1.6 個 NMSC(16)。莫式顯微手術 (Mohs micrographic surgery) 是常用於治療皮膚癌的手術,其方法是在去除主要腫塊 (debulking) 之後,用水平切削的方式移除組織,每一層切下來的組織都用冷凍切片檢查是否癌細胞有全部移除乾淨。如果還有殘留的癌細胞,則繼續向下切除組織,再冷凍切片檢查,直到邊界乾淨為止,這種方法可以檢查 100% 的手術邊界,所以減少腫瘤復發機會,留下的組織缺損少,有利於後續重建與美觀的保存。缺點是冷凍切片檢查相當的費時,每次需要 30-60 分鐘,且會有冷凍偽影 (freezing artifact),並且其品質相當仰賴技術員的水準(17)。為了克服上述困難,LLTech 公司開發出 FF-OCT 技術的 Light-CT Scanner,可以掃描切除下來的皮膚組織,不需要染色就可以得到組織影像。但是因為其解析度只有 1.5 mm,所以在一些腫瘤邊緣位置無法正確的辨別腫瘤細胞與發炎細胞。

圖 7. 活體皮膚之斷層影像。(a) 40×,(b) 20× 物鏡 (視域 500 mm × 300 mm),包含對角質層(stratum corneum, SC)、顆粒層 (stratum granulosum, SG)、棘狀層 (stratum spinosum, SS)、表皮/真皮交界 (dermal-epidermal junction, DEJ)、微血管、小血管、汗腺及至黑色素的標註。
除了皮膚癌,人體大於 80% 的癌症,均屬表皮癌 (epithelial cancer),是 OCT 可直接或經由內視探針/光纖探針加以成像,目前染色切片的病理檢驗是診斷許多癌症的黃金標準(gold standard),隨著 OCT 在無侵襲性、高速及高解析技術推演,未來有機會取代病理檢驗,這種免去活體切片 (excisional biopsy) 的光學切片 (optical biopsy) 或虛擬切片 (virtual biopsy) 技術,可說是 OCT 技術最終的聖杯 (Holy Grail)。
四、OCT 的趨勢與挑戰
歷經了近 30 年的快速發展,OCT 在高速、高解析成像已獲得長足的進步,藉由各式內視探頭、光纖探針、乃至穿刺探針,人體各部分均已可加以高清晰成像,然而臨床上的應用,目前仍是以視網膜為主,如何繼續拓展,有賴深入探索臨床上尚未被滿足的需求,這需要光電、電子、機械、醫學領域的專家,密切的跨領域合作才有機會加以突破。
矽光子 (silicon photonics, SiP) 技術近年來的快速發展,除了在光通訊及資料中心的應用外,未來在 OCT 亦有很大的潛力,在近紅外波段中矽波導不吸收的波長範圍 (i.e. l > 1.1 mm),寬頻的光耦合器、分波多工器、光調變器、光偵測器、陣列光波導 (array waveguide),均有機會大幅降低 OCT 系統的體積、價格,促成經濟型手持式 OCT 的實現,這對推動 OCT 於小型或鄉村型診所可起很大的助力,但這些矽光子元件的功效規格上,目前仍與相對應的體積型 (bulk) 元件有落差,如何持續提昇這些矽光子波導元件的特性是不小的挑戰。在可見光至近紅外光範圍的矽晶圓可吸收的波長範圍 (i.e. l < 950 nm),一維及二維的 CMOS 感測器,目前雖已廣泛應用於手機等消費性電子產品,但由於成像速率 (frame rate) 不高及每一畫素所能容納之電子數 (full well capacity, FWC) 較少,並不適用於 SD-OCT 或 FF-OCT 的使用,所幸,近年來已有多家新創公司開發了高速及高 FWC 的 CMOS 感測器 (例如:Adimec, Luxima),這對 OCT 在未來繼續提昇成像速率、靈敏度乃至光譜分析功能,均可產生很大助益。以 OCT 的光譜分析功能而言,藉由 OCT 的寬頻光源、干涉架構及高速 CMOS 感測器,OCT 不但可量測生物組織的形貌、結構,更可做背向散射的光譜量測,以檢測生物組織的成份(18),但如何提昇頻譜分析的靈敏度,以鑑別生物組織內的成份,如黑色素、血紅素等,仍有不小的挑戰。
OCT 所產生的二維或三維灰階 (grey level) 影像,並非醫師所熟悉之染色影像,形成臨床導入之障礙,近幾年,人工智慧進展飛速,尤其是深度學習演算法 (deep learning algorithm),非常適合與 OCT 結合,以輔助醫師做組織影像之偵測 (detection)、分類 (classification)、分割 (segmentation) 乃至診斷,有機會大幅加速推進 OCT 在臨床上的應用,如圖 8 所示,深度學習在病理檢測的應用是熱點之一,以輔助醫生在病理切片乃至高解析之組織光學影像做判讀。但深度學習演算法的有效運用,須要大量的醫師對影像的標註(annotation),由於臨床醫師平日繁重的門診及住院病患照顧工作,已很忙碌,難有餘力做大量標註,因此如何藉政府或醫院提供醫師誘因,以促成人工智慧輔助診斷的實現是一大挑戰。
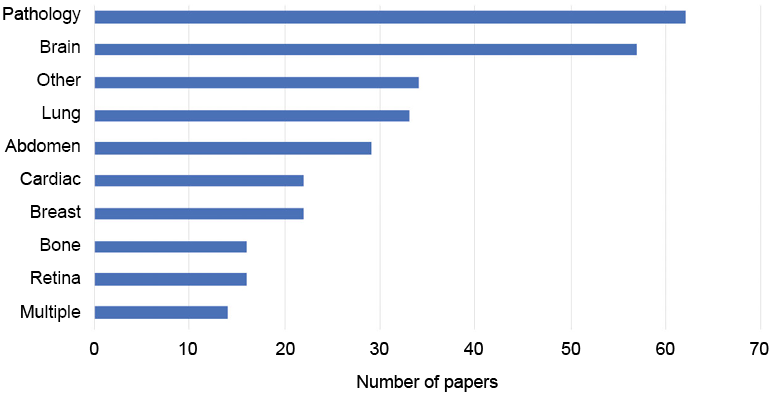
圖 8. 深度學習演算法在醫學影像分析應用之論文發表數(19)。
五、結論
展望未來,OCT 由細胞/組織的生理結構、細胞間的交互作用、生理信號的激活路徑乃至結合雷射治療,均有很大發揮的空間,尤其生理結構上的微小變化,經常比組織的功能惡化/喪失更早發生,因此,OCT 在早期疾病/癌症的診斷上,特別有臨床效益。
就轉譯醫學 (translational medicine) 的角度而言,由基礎研究進展到日常的臨床應用有賴整體研究生態系統的建構,包含:物理、工程、臨床醫學;政府對基礎與臨床研究的補助;在學術圈的合作與競爭;創業精神與產業的支撐;發掘真實的臨床需求;藉由創新創業以跨越學科的界限,最終才能促成經濟與社會的效益。台灣的醫療水平國際知名,加上 ICT 技術的強大國際競爭力,未來極有機會在 OCT 領域於國際上發光發熱,希望藉由本文對 OCT 的介紹,能夠吸引更多國內優秀的生醫光電團隊,共同促成 OCT 在生技醫療上各式疾病乃至癌症的臨床應用。