運用雙光子共軛焦顯微鏡即時影像技術觀察活體動物疾病模型
Applications of Two-photon Confocal Microscopy for Real-time Imaging of Animal Disease Models
現今多數的疾病研究中,常以活體動物模型做為實驗對象,透過皮下或血管注射藥物、細胞或顯影劑,並經由體內循環、代謝或生長而得以研究疾病的發病機制及藥物的作用。在需長期觀察的活體實驗中,我們無法利用病理切片的方式來即時檢測病變組織。由於病變組織具三維結構,為順利觀察不同深度及面向之血管及新生腫瘤,本實驗室利用雙光子共軛焦顯微鏡 (two-photon confocal microscope) 來進行即時攝影觀察病變組織內的細胞行為。在本文中將以小鼠及雞胚胎的疾病模型為例,展現雙光子共軛焦顯微鏡擷取影像的成果。
In modern biomedical research, living animals are often used as disease models. To observe the disease states, it often requires subcutaneous or intravenous injection to introduce drugs, cells or contrast agents. For long-term observation, it is not practical to conduct biopsy to instantaneously check the status of pathological tissues at different time points. Therefore, it is desirable to utilize noninvasive tools such as intravital imaging to investigate the three-dimensional structure changes in the disease models. In this article, we will discuss the applications of two-photon confocal microscopy for the real-time imaging in live animals. We will focus on disease models based on mouse or chick embryo chorioallantoic membrane (CAM) models.
一、淺談雙光子共軛焦顯微鏡的原理與應用
1. 關於雙光子共軛焦顯微鏡
光學顯微鏡是生命科學研究中最常用的儀器之一,藉由其光學放大的特性,我們可以利用顯微鏡觀察細胞及組織在微觀世界的結構與功能,若結合不同的染色技術,更可了解不同蛋白質在空間的分布與功能。然而,由於位於不同焦平面的訊號會同時出現在觀測者的眼中或偵測器上,使得我們無法清楚分辨訊號位於縱軸上的哪一個平面,因此一般的顯微鏡無法獲得清晰的三維影像。為解決此問題,科學家發展了共軛焦 (confocal) 成像技術,利用雷射掃描、針孔及高靈敏度偵測器,有效去除樣品在非焦點平面的干擾,達到光學切片 (optical sectioning) 的效果。在分層掃描後,利用軟體疊加縱軸上各分層的影像,我們便可重建樣品的三維影像(1, 2)。例如利用蛋白質染色技術,共軛焦顯微鏡便可以清楚呈現各種蛋白質在細胞或組織內的三維分布。因此,共軛焦顯微鏡是目前生醫研究不可或缺的利器。然而,在研究動物疾病模型時,因為疾病組織大多位於動物體內,光線會因穿透多層細胞被吸收或散射而快速衰減,無法到達深層組織,因此共軛焦顯微鏡很難直接用來觀測活體組織,通常需要利用病理切片將組織從活體移出才可觀測組織的結構。為解決此問題,科學家利用在活體組織內吸收較低散射較小的近紅外光雷射及非線光學開發出雙光子共軛焦顯微鏡來觀察深層組織。一般的染料或螢光蛋白都需利用可見光來激發,而近紅外光因單光子能量不足無法直接激發這些分子產生螢光,所以利用非線性光學的特性,結合兩個近紅外光子來激發染料分子產生足夠強度的螢光(3)。雙光子的螢光訊號與雷射強度平方成正比,只有在聚焦時才有足夠的雙光子強度來激發螢光分子,因此雙光子螢光訊號僅在焦平面上產生,在焦平面上方或下方都因雙光子的強度不足不會產生螢光訊號,所以不需特別利用針孔濾去非焦平面的訊號。此外,在焦點上的雷射強度很高,不能排除高階非線性光學激發的可能,如三光子激發,因此我們有時會使用多光子共軛焦顯微鏡來涵蓋所有可能的螢光來源,為方便描述,本文著重在雙光子共軛焦顯微鏡的介紹。
雙光子共軛焦顯微鏡運用於觀察細胞在活體的深層組織中的行為,尤其是研究疾病模型中細胞在病變組織的行為更可以直接驗證疾病的機制與藥物治療的效果。然而活體動物即使處在麻醉狀態下,心臟跳動及呼吸都會使在顯微鏡視野內的組織因移動而使影像模糊。此外,血液流動快速,難以捕捉細胞在血流中的行為。要如何解決因為呼吸心跳引起的影像模糊一直是科學家想要解決的問題,使用新進發展的高速影像擷取系統如高速攝影機或快速掃描器,可以成功的避開上述問題,取得優質圖像。舉例而言,在我們實驗室中所使用的 Olympus FVMPE-RS 多光子共軛焦顯微鏡有內建兩組掃描器,我們能依照實驗需求選取影像擷取速度,利用一般掃描器,我們可以在一秒左右取到一張 512 × 512 像素高畫質的影像。如果利用共振掃描器 (resonant scanner),我們可以在一秒內取到 30 張具同樣畫素的影像,並製成即時影像。利用共振掃描器雖然可以取得即時影像,但在同一畫素上,雷射停留的時間僅是原來的 1/30,所以訊號相對減弱。雖然增加雷射強度可增強訊號,但因高強度雷射可激發組織的自體螢光而降低訊噪比,使影像充滿雜訊。在高強度的雷射下,螢光分子會快速的衰退而無法產生足夠的訊號,組織也會因暴露在高強度雷射時間過長而被破壞。因此,在擷取即時影像時不宜於組織的同一位置上掃瞄過久。
2. 雙光子共軛焦顯微鏡與一般共軛焦顯微鏡的差異與優勢
雙光子共軛焦顯微鏡與一般共軛焦顯微鏡最大的差異在於其所使用的雷射光源。為利用非線性光學現象達到雙光子或多光子激發,通常需要使用高強度雷射。如果所用的光源為連續光雷射,其所需能量會過高而導致樣品損壞。因此,一般雙光子共軛焦顯微鏡都是利用超快的脈衝光雷射,其脈衝寬度通常在 100 飛秒左右,將能量較低的光源聚焦於短時間的雷射脈衝內而達到相同的雷射強度。受限於可用的商業雷射種類,一般用於雙光子共軛焦顯微鏡的雷射波長範圍大約在 700-1040 nm,也就是在近紅外光波長。動物組織在這個波長範圍的吸收較少,因此可穿透較深層組織來觀測細胞的活動。由於生物組織通常含有可以激發的螢光分子而產生自體螢光,且該吸收光波長大約在可見光區間,因此當使用一般雷射掃描顯微鏡時,自體螢光與螢光染劑的顯色容易混淆。如透過雙光子共軛焦顯微鏡,則能調整激發光波長至近紅外光,便可屏蔽可見光的雜訊。然而,如果所使用的標示螢光太弱,則必須使用很高的雷射強度,造成在焦點上自體螢光增強干擾到雙光子螢光訊號,活體的自體螢光波長常隨實驗動物的種類而有所差別,需隨實驗測試自體螢光的激發與螢光波長調整激發波長與濾鏡來降低自體螢光的干擾。相較於一般共軛焦顯微鏡使用多台固定波長雷射來激發不同染料分子,雙光子共軛焦顯微鏡僅需一台超快雷射,其激發波長可調,然而因為多光子激發機制,不同的染料分子可能會被同時激發,因此在選定標示螢光分子時要特別小心,避免不同螢光訊號彼此干擾。
雙光子共軛焦顯微鏡比一般雷射掃描顯微鏡具有對生物體本身更低的危害性,且在觀察的過程當中可以快速擷取到大量的影像資料,具備更高的效率。雙光子共軛焦顯微鏡在生醫領域中應用的範圍包括活體內部器官組織的深度觀察、微觀血管內抗體、各種細胞和組織的形態學研究及藥物的監測,廣泛運用於神經解剖和生理學的研究。我們能在動物實驗過後,利用雙光子共軛焦顯微鏡可獲得一般顯微鏡無法獲得的即時深層組織影像,可以持續觀察疾病的演變過程,幫助我們了解疾病進展過程以及機制。
二、雙光子共軛焦顯微鏡於疾病模型的應用
1. 雙光子共軛焦顯微鏡在不同小鼠疾病模型的應用
在生醫領域當中,由於小鼠的基因組成、動物行為特徵都和人類非常相似,且小鼠生命狀態穩定、繁殖能力強,在長期觀察或是對於同一個體的持續實驗時,利用小鼠進行操作不僅能降低成本,在取樣特定組織時也能減少負擔,因此時常被選定為實驗動物。在利用雙光子共軛焦顯微鏡研究活體動物時最重要的實驗技巧是如何選擇標示螢光源,一般來講有兩大類方法:一種是利用螢光染色結合抗體標示特定蛋白質,另一種則是利用基因編輯技術在細胞內導入螢光蛋白。利用抗體結合螢光物質如染料或量子點或單純使用螢光分子,是一種較為簡單的染色方法。然而,在大多數的情況下,螢光分子及抗體需經由血液送達組織,常因其分子量太大,無法有效穿過血管到達想要研究的組織,且這些外來物質會被代謝或清除而致使濃度逐漸降低無法長期有效觀測。利用基因編輯技術導入螢光蛋白又有兩種方式,比較簡單的是在體外轉染螢光蛋白至細胞,再將具螢光蛋白的細胞移至體內,例如將螢光蛋白轉染至腫瘤細胞,再將腫瘤細胞移植至模型動物體內,當腫瘤形成時我們可以觀察到在腫瘤內每個細胞都帶有螢光。我們亦可將帶有螢光蛋白的免疫細胞經靜脈注射打入動物體內,利用雙光子共軛焦顯微鏡觀察免疫細胞的行為,然而因原生免疫細胞不具螢光蛋白,我們無法觀測到原生免疫細胞的行為。要觀察此類細胞,可利用基因編輯技術直接將螢光蛋白導入受精卵中,使得模型動物的特定細胞都帶有螢光蛋白,不過此類技術較為複雜且費時。我們藉由以下幾個例子來說明實際的實驗過程。
首先我們以小鼠腫瘤模型為例,說明雙光子共軛焦顯微鏡如何應用在癌症的研究。為了形成腫瘤,先離體 (ex vivo) 培養不同的癌細胞株,在麻醉小鼠後我們可藉由皮下注射,將約一百萬個癌細胞注射至小鼠的背部,或是利用手術將癌細胞注射至腫瘤相對應的器官形成原位癌。當腫瘤形成後,因為癌細胞帶有螢光蛋白,我們可利用雙光子共軛焦顯微鏡觀察腫瘤內的癌細胞。皮下的腫瘤因為較接近皮膚,雷射穿透深度夠,可以直接觀察。而體內器官的原位癌,因處於深處,雷射光無法穿透需安裝透明的觀察窗來觀察。為了方便長期觀察,本實驗室發展了耳部腫瘤模型,將癌細胞直接注射到小鼠的耳背,形成腫瘤。因為耳部皮膚組織較薄,在深度上的取樣較不易受到阻礙,我們可以長期觀察腫瘤的形成及藥物的分布。圖一為帶紅色螢光的胰臟癌細胞 (BXPC3-RFP) 形成的腫瘤的雙光子影像,其中紅色是胰臟癌細胞,為了觀察腫瘤中的血管,我們利用靜脈注射引進血管顯影劑 (FITC-Dextran),從影像中可以清晰看到,腫瘤外部佈滿血管,有些血管穿透腫瘤組織。利用雙光子顯微鏡有另一個好處是,細胞外間質如膠原蛋白會產生二倍頻的非線性光學信號,讓我們不需經由螢光標示就可觀察到細胞外間質的分布,了解腫瘤組織周圍的微環境。圖 1 中的白色就是二倍頻的訊號,代表腫瘤組織的外圍被細胞外間質所包覆。在這個實驗中多我們先使用低放大率的物鏡 (MPlan N 5X, Olympus) 來對焦,再用具近紅外校正功能的水浸物鏡 (XLPlan N 25X/1.05 NA, 2 mm WD, Olympus) 來取得腫瘤組織的影像。此處的觀察由於容易受到動物表皮厚度的影響,使用雙光子共軛焦顯微鏡紀錄時,可利用微手術將內層血管表露出後再進行對焦觀察,同樣能藉由 Z 軸影像掃描,獲得三維的即時影像,並能加以分析測量出腫瘤位置、深度、大小等。
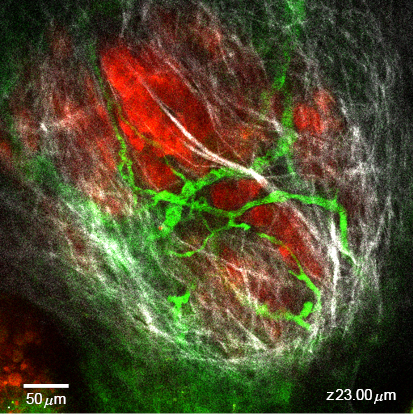
圖 1. 裸鼠耳部腫瘤組織的雙光子影像,紅色為胰臟癌細胞 (BXPC3-RFP),綠色為血管,白色是細胞外間質產生的二倍頻訊號。
由於實驗動物一般具有自體螢光 (autofluorescence),在利用螢光顯微鏡掃描時易受到干擾,不過由於雙光子共軛焦顯微鏡可調整雷射光波長,我們可以藉由轉換至相異波長區間來屏蔽自體螢光的影響,例如在分辨血管內血球與注射之紅色螢光抗體時,兩者的對比顯色會更加明顯。甚至,在觀察的途中,我們能即時加入多種螢光顏色的不同抗體、細胞,藉由雙光子共軛焦顯微鏡的即時影像處理,能透過疊圖分析出不同樣品之於活體動物體內的分佈位置與性質。我們透過氣體麻醉系統,使裸鼠暫時昏迷,來造就得以穩定觀察的環境。然而,當我們利用老鼠進行顯微鏡觀察時,會遇到毛髮及心跳震動的影響,使影像出現不易對焦、影像模糊的現象。倘若是血管影像的擷取,我們能以耳部、皮下血管來觀察可有效避免由心臟跳動而影響微觀的觀察結果。若是在腹部、背部、內部器官的觀察上,我們能透過玻片輔助,將其表面呈現愈加平坦,對於微觀的對焦則能愈加順利。
結合雙光子共軛焦顯微鏡與耳部腫瘤模型,我們可以在同一個地方長期觀察腫瘤組織,了解腫瘤細胞的行為或藥物如何到達腫瘤組織。了解藥物如何到達腫瘤組織是癌症研究的一個重要議題,我們為了模擬藥物的傳輸機制,先將修飾有特定抗體的量子點以靜脈注射的方式引入小鼠的循環系統,利用奈米載體 (量子點) 的高滲透長滯留效應 (enhanced permeability and retention effect) 及特定抗體與癌細胞表面抗原的專一結合能力,可以在腫瘤組織內觀察量子點 (或藥物) 在腫瘤上不同時間的累績,因為量子點有很好的光學特性,我們可以很清楚地觀察到腫瘤組織裡的量子點。圖 2 為耳部腫瘤模型在注射量子點前後的多光子影像。上方的影像為腫瘤形成前後耳背的多光子影像,白色為二倍頻訊號代表細胞外間質,紅色為胰臟癌細胞 (BXPC3-RFP),單顆腫瘤細胞可被清楚觀察到。下方則為注射量子點後,不同時間腫瘤組織的多光子影像,綠色為量子點的訊號。我們可以觀察到在不同時間點,量子點在腫瘤組織內的分布不同。利用類似的實驗設計,我們可以研究帶有藥物的奈米載體如何進入腫瘤組織及如何與腫瘤細胞作用。

圖 2. 上方的影像為腫瘤形成前後耳背的多光子影像,白色為二倍頻訊號代表細胞外間質,紅色為胰臟癌細胞 (BXPC3-RFP)。下方則為注射量子點後,不同時間點的腫瘤組織雙光子影像,綠色為量子點的訊號。比例尺:50mm。
當腫瘤長到一定程度後,有些腫瘤細胞會離開腫瘤組織穿過血管壁進入血液循環,在血液循環中的這些腫瘤細胞有少部分會在適當的組織再鑽出血管形成細胞群落,這個現象就稱為腫瘤轉移。在腫瘤轉移的過程中,我們將會在血液中循環的腫瘤細胞,稱為循環腫瘤細胞。近來的研究顯示,血液中循環腫瘤細胞的數目與型態與病人的存活率有很大的關聯,因此,研究循環腫瘤細胞的行為是另一個癌症研究的重點議題。然而,這些循環腫瘤細胞的數目非常稀少,在十毫升的血液裡大約有一百億顆紅血球,五千萬顆白血球,但在同樣體積的病人血液中僅有一至一百顆循環腫瘤細胞,非常不容易觀測與分離。利用快速掃描技術,雙光子顯微鏡可以研究腫瘤細胞在血液中的行為。我們利用前述所建立的耳背腫瘤模型,可以長期觀測循環腫瘤細胞的行為,我們認為,單位血液體積的循環腫瘤細胞數目很低是因為一般取樣的位置遠離腫瘤,所以樣品會是全部血液的平均值。如果我們能在腫瘤旁邊取樣,則可偵測到的單位體積內的循環腫瘤細胞就會變多,在有限的時間內我們可捕捉到較多的循環腫瘤細胞(4)。當我們利用雙光子顯微鏡直接觀察腫瘤附近血管內的循環腫瘤細胞,其數目遠高於平均數。圖 3 是我們在某一瞬間的取樣影像,血管 (綠色) 中的循環腫瘤細胞 (紅色) 清晰可見。我們在同一地方不同時間取樣發現隨著腫瘤的尺寸變大,所測得的循環腫瘤細胞也跟著變多,整個實驗為期四至六周。我們也通過利用免疫螢光染色的技術,可以清楚觀察到在所測得的循環腫瘤細胞中有百分之一到三的群體帶有幹細胞特性,或許這些循環腫瘤幹細胞可以做為癌症治療的主要目標,以控制腫瘤的轉移,這需要更多的後續研究來支持。

圖 3. 紅色為胰臟癌細胞 (BXPC3-RFP)。綠色為腫瘤組織附近的血管,血管中的紅色為循環腫瘤細胞 (如箭頭所示)。曝光時間為三十毫秒。
在所有的器官中,心臟影像的取得是最困難的,因為心臟跳動頻率很高且位移很大。尤其在小鼠的動物模型中,因其心跳約為每分鐘四百到六百下,是人類心跳的七到八倍,很難獲得清晰且穩定的影像。為了解決此問題,我們實驗室利用心電圖的訊號同步雙光子共軛焦顯微鏡的掃瞄儀並結合其他穩定裝置,可獲得穩定的影像。活體心肌細胞中的幾百奈米的結構變化可以被清楚觀察到,同時我們也可追蹤單一血球在心臟血管的行為,此技術對研究心臟病的機制與治療提供了非常有效的影像支持。在模擬心肌梗塞的動物模型中,我們會利用手術將冠狀動脈的血流暫時阻斷,在此過程中血液中的單核球會聚集在發生心肌梗塞附近的組織。圖 4 是單核球在活體心臟的雙光子影像,紅色是血管而綠色是單核球,我們可以發現在正常的心臟上的單核球很少,而在心肌梗塞模型的心臟上聚集了許多單核球。同時利用即時影像技術,我們可以紀錄單核球如何從血管聚集到損傷組織。在此實驗中,我們利用基因轉殖鼠,帶有 CX3CR1 受體的單核球會表現綠色螢光蛋白。
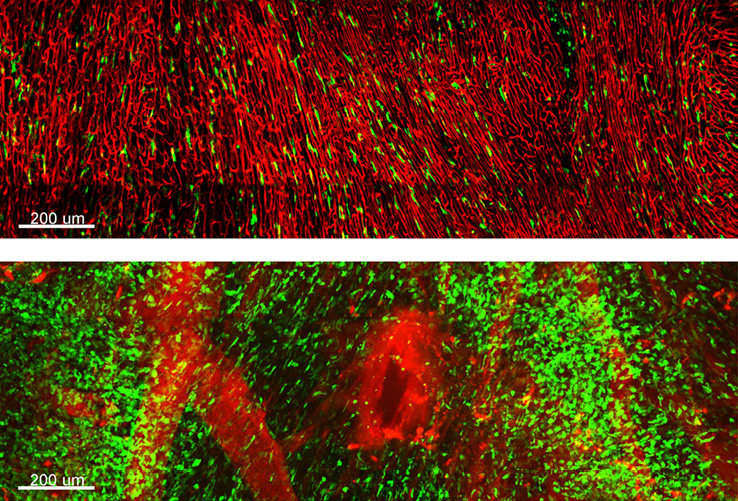
圖 4. 單核球在心臟上的多光子影像。紅色為血管,綠色為帶有 CX3CR1 受體的單核球。上方是正常的心臟,下方則是心肌梗塞模型的心臟,整個視野都是受損的組織。
2. 雙光子共軛焦顯微鏡於雞胚胎影像的應用
在以活體為實驗對象時,若考量到進行實驗的效率及成本,且欲在短時間內獲得大量數據及影像,我們會採用雞胚胎為實驗對象尤其是與癌症相關的疾病模型。在雞胚胎膜上充滿微血管,若將病人的癌變組織或癌細胞置於膜上,可以快速的形成腫瘤組織,非常適合研究血管增生或癌症藥物篩選。一般已受精完成的雞蛋,孵化天數約為 21 天,且在第三天左右 (需根據孵化溫度、濕度而定,通常設定為 37.5度、濕度 50-60%),能在雞蛋中觀察到明顯的血管以及出現心跳的胚胎。當血管發育至一定大小、胚胎狀態也更加穩定後,大約在第五到七天,為進行實驗的最佳時機,圖 5 展示雞胚胎初期孵化過程。
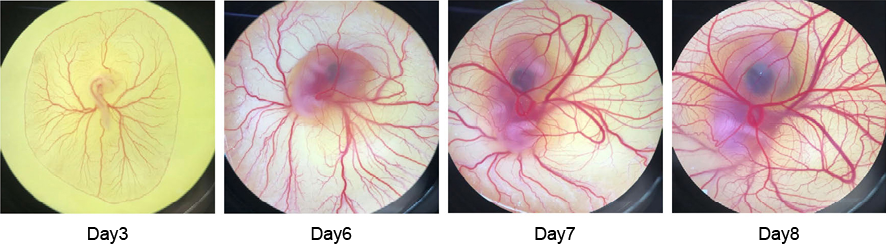
圖 5. 雞胚胎在不同孵化天數下的影像,紅色為血管。
在本實驗中以人類結腸癌細胞 (HCT116 Cells) 進行操作,我們利用雙光子共軛焦顯微鏡可以取得人類結腸癌細胞所形成的腫瘤組織如 (圖 6) 所示,在植入雞胚胎樣本後兩天,於血液中可以清楚的捕捉到循環腫瘤細胞,並能持續追蹤人類結腸癌細胞植入後三天到五天之循環腫瘤細胞的連續影像,可計算其細胞數量是否增加、侵略範圍是否擴散,甚至集中聚集在血管外形成遠端轉移的腫瘤。同時,我們也嘗試以 CD24 抗體 (Anti-CD24 Antibodies, PE) 標記血液中循環腫瘤細胞,減少人為判斷誤差。若透過雙光子共軛焦顯微鏡,我們觀察到雞胚胎中已生長出腫瘤,能加以記錄且分析生長大小,也能藉由在縱軸上取得連續影像,以了解生長位置及深度。

圖 6. 左方為雞胚胎膜上的腫瘤,右方為腫瘤組織的多光子影像,紅色為人類結腸癌細胞,綠色為螢光標記的細胞角質蛋白。
在進行實驗的過程當中,我們發現使用雞胚胎為實驗對象時,由於胎齡較小,所以活體心臟跳動幅度也較小,使用顯微鏡觀察、擷取影片時的穩定度相對於其他種類的實驗動物高,無論在計算循環腫瘤細胞的數量或是觀察血管等微小器官,皆使得影像的呈現及實驗的進行更加順暢。並且,由於所需孵化天數較少,使用雞胚胎為實驗對象時也能快速取樣並在短時間內取得可用數據,針對時間較不寬裕的實驗項目,以雞胚胎做為實驗對象是很好的選擇。
相對於成熟的活體樣本,雞胚胎較為脆弱,淘汰性較高,實驗進行的時間也不宜過長。雞胚胎一般須保持在溫暖且濕度適中的環境之下,一旦離開孵育場所,暴露在空氣中,胚胎容易失溫,水分也易流失。在實驗的過程中,我們會以暖燈和平衡鹽試劑 (Hank’s Balanced Salt Solution, HBSS) 輔助,有益於延長實驗時間。並且,在使用雙光子共軛焦顯微鏡進行實驗時,由於物鏡具有一定寬度,當聚焦逐漸縮短時,可能會受到胚胎蛋殼影響而無法深入胚胎對焦,因此在進行實驗時,可將蛋殼剝開至一定程度,或直接將胚胎孵育在培養皿中即能改善。
此外,雙光子共軛焦顯微鏡為方便螢光對焦,使用之水浸物鏡需藉由水為介質觀察樣本,當我們使用雞胚胎為觀察對象時,其表面包覆的蛋白與蛋黃膜也會增加對焦的困難度,我們可以藉由玻片或生物膜來防止胚胎沾黏。同時,在深入對焦時,若上層物質過厚或上層具有蛋殼、懸浮物質,在運用顯微鏡觀察時容易受到干擾,因雙光子共軛焦顯微鏡具有可調整式光波長,我們能以移動位置對焦的方式,或使用雙光子共軛焦顯微鏡具備的低放大率物鏡對焦,確認觀察物質的特性再加以判斷,即可有效避免系統誤差的產生。
三、結論
總而言之,無論是在以小鼠或是雞胚胎的活體實驗中,我們能藉由雙光子共軛焦顯微鏡,根據實驗需求調整內建掃描器的速度和激發光波長來獲得穩定且高解析度的即時影像,記錄細胞在活體動物內不同器官或組織內的行為。若能結合適當的染色技術如螢光蛋白染色或帶螢光的抗體,我們可更進一步監測在活體中於不同階段的病變組織結構,將不受限於組織切片的既定染色,獲得資訊更多的活體影像。